研究統括:西村
![]()
以下に各研究プロジェクトについて、最近の成果を示します。大学院生の皆様には、いずれの研究プロジェクトも、基本的な組み換えDNA技術、RNA取り扱い技術、蛋白化学解析技術、細胞培養技術、および動物実験技術などを習得して頂いたうえで取り組んで頂きます。研究分野に詳しくない方々には、高校生・大学生むけに研究室を紹介した別項目、および和文総説をご参照ください。
1)T細胞レセプターを介したCD4+Th細胞の活性化に関わる細胞内シグナル伝達機構の解析
樹状細胞などの抗原提示細胞は、蛋白質を細胞外から取り込んでエンドソーム内で分解してペプチドを産生し、これをMHCクラスII分子に結合して細胞表面に発現します。CD4+Th細胞は、細胞表面に発現する抗原受容体であるT細胞レセプター(T cell receptor; TCR)を介して、抗原提示細胞表面の自己のMHCクラスII分子に結合した非自己抗原蛋白質由来のペプチドを認識して様々な反応を示し、生体防御を担う免疫応答を制御しています。たとえば、他のT細胞や抗原提示細胞等の免疫担当細胞の活性化を促す液性因子(サイトカイン)の分泌、自己の増殖応答、さらに標的となる細胞の傷害などを行い、外来からの異物を排除しようとします(和文総説参照)。このようなT細胞の様々な活性化反応は、図1に示すようにTCRによって細胞内に伝えられたシグナルにより引き起こされます。細胞内に伝えられたシグナルは、様々なキナーゼと呼ばれる酵素を活性化して、その結果いろいろな蛋白質がリン酸化されて、その活性が調節されます。最終的に遺伝子の発現を制御する転写因子の活性が変化して、遺伝子の発現が促進されたり抑制されたりして、上記のT細胞の免疫応答が生じます。
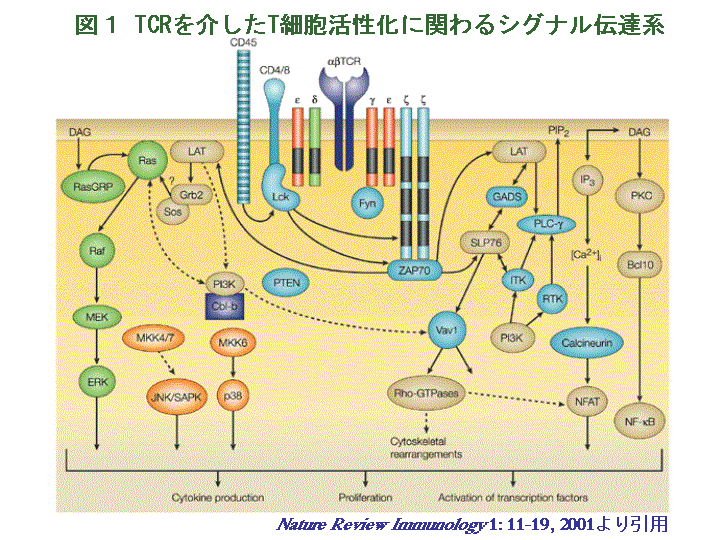
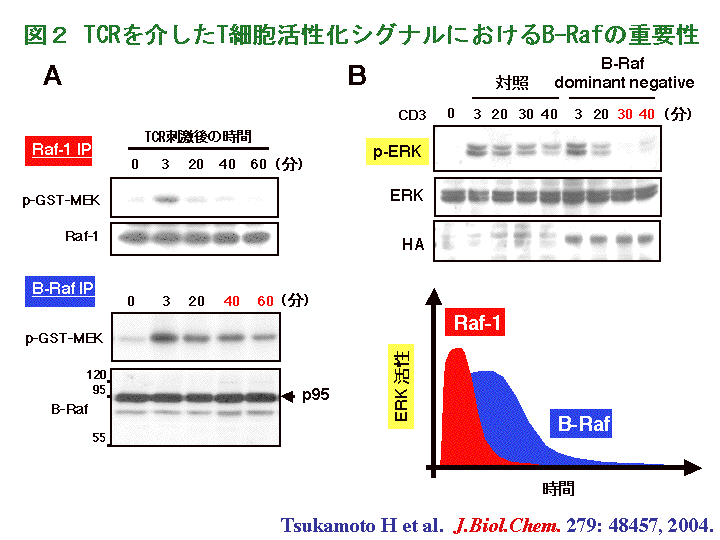
我々はヒトT細胞の活性化応答を決定する細胞内シグナル伝達分子に注目して解析を行っています。その一つとして、我々はRafファミリー分子の一つであるB-Rafというセリンスレオニンキナーゼを中心としたシグナル伝達経路が、重要な役割を担っていることを発見しました。B-Rafはメラノーマに代表される癌細胞において変異が認められ、現在癌化のメカニズムの解明において、注目されている分子の一つでもあります。我々はB-RafがT細胞においても発現しており、TCRからの刺激により活性化が誘導されることを発見しました(図2 A)。また、T細胞に発現する同じRafファミリー分子であるRaf-1に比べると、その活性化はより持続していました。このことから、B-RafはRaf-1とは異なる働きを担っていると予想し、B-Rafの活性化を抑制するdominant negative変異体を細胞へ導入することにより、B-Rafの活性化を抑制して見ました。すると、B-Rafの活性化が抑制された細胞では、重要なシグナル伝達分子であるERKの活性化が長続きしないことが分かりました (図2 B)。したがって、B-RafはERKの活性化を持続させる働きを持つことが示唆されました。さらに、B-Rafの活性化および、それに引き続いて生じる持続的なERKの活性化は、T細胞の増殖応答に必要なサイトカインであるインターロイキン-2(IL-2)の産生誘導に、必須であることも明らかにしました。(関連する英文論文)
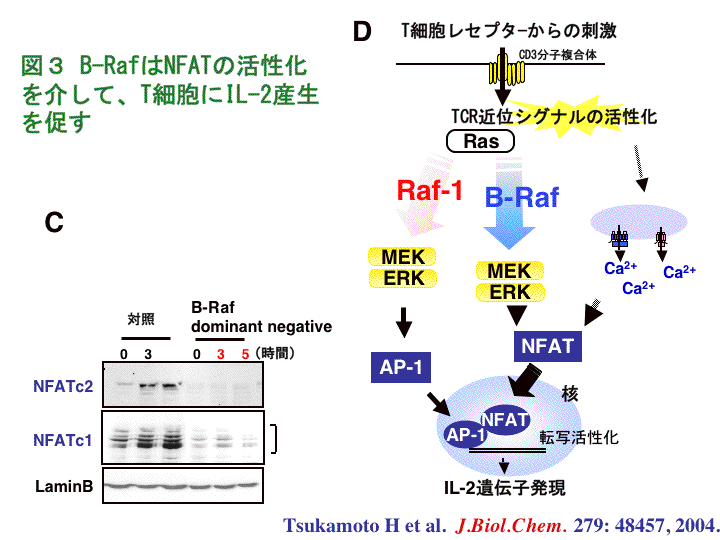
さらに、我々はどのようにしてB-RafがIL-2の産生を制御しているのかという疑問を持ち、解析を進めました。その結果、B-Rafの活性化が抑制された細胞では、IL-2の産生に必要とされる転写因子であるNFATの、核への移行および活性化が抑制されていることを突き止めました(図3 C)。以上より、B-RafはERKの持続的な活性化を制御し、NFATの細胞質から核への移動を誘導することにより、IL-2の産生に寄与しているものと考えられます(図3 D)。
我々はB-Raf以外にもT細胞の活性化に重要な新規分子を同定しており、今後、プロテオーム解析や動物実験などを駆使して、T細胞内で時空間的に制御されているシグナル、それによって制御される生体内の多種多様な免疫応答について、さらなる解析を行なっています。
2)遺伝子改変樹状細胞(DC)を用いたDC発現遺伝子の機能解析、および抗原特異的免疫制御療法の開発
抗原提示細胞とは、異物である抗原を細胞内に取り込んでペプチドへと分解したのちに、これをHLA分子に結合して細胞表面に発現することにより、T細胞に抗原の存在を知らせて、その排除に関わる免疫反応を刺激する細胞です(和文総説参照)。最も強力な抗原提示細胞である樹状細胞
(dendritic cell; DC)
は、抗原を取り込んだ後に、種々の遺伝子の発現を変化させて成熟してゆきます。この間に細胞の形、抗原の取り込み能力、抗原やHLA分子の輸送などの様式が大きく変化して、T細胞に抗原を見せて活性化する能力が著しく高まります。DCは常に外界と接している皮膚、粘膜において感染防御に重要な役割を担っています。さらに、近年DCに抗原ペプチドを負荷したり、抗原遺伝子を導入・発現させたものを患者に投与することにより、病原微生物や癌細胞への攻撃力を高める免疫応答を増強する、強力なワクチン効果を誘導できることが示されています。
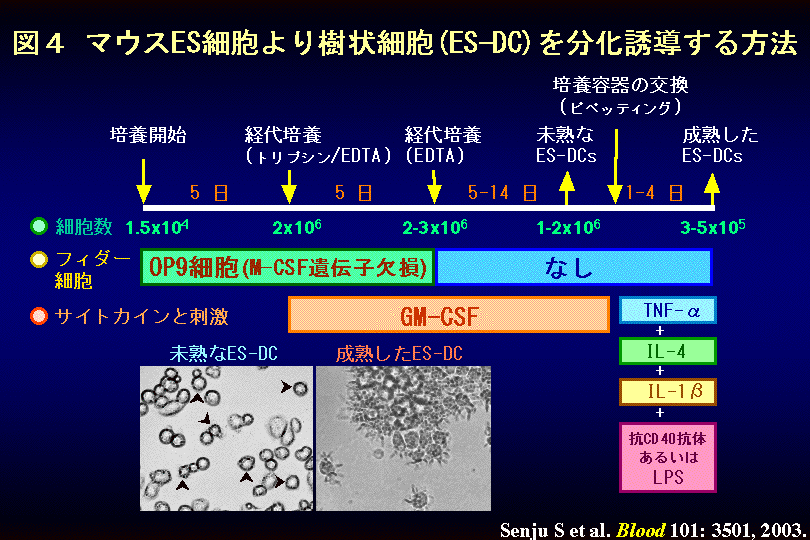
我々は、マウスの胚性幹細胞(Embryonic Stem Cell :ES細胞)から、in
vitroにおいて樹状細胞(ES-DC細胞)を分化させる方法を確立しました。さらに、ES-DCの遺伝子改変により、免疫応答を制御できる細胞ワクチンの開発に成功しました。図4に、その方法を示します。マウスES細胞(TT2)をin
vitroにおいて、OP9
骨髄ストローマ細胞株(M-CSF欠損)とGM-CSF存在下に培養することにより、抗原をプロセスしてT細胞に抗原を提示して活性化できる機能を有する樹状細胞(ES
cell-derived dendritic cell: ES-DC)
を、分化誘導する方法を確立しました。LPSなどの刺激を加えるとES-DCは成熟し、典型的なDCの形態と機能を発現します。(関連する英文論文)
さらに最近、特定の遺伝子発現ベクターを用いることにより、ES細胞の段階で遺伝子導入を行い、ES-DCに分化誘導した後に、その遺伝子を発現するES細胞クロ−ンを高い効率で得る方法を開発しました。ES細胞からのDCの誘導法ならびに遺伝子の導入と標的破壊法を応用し、ES細胞の段階で遺伝子改変を行ない、これを樹状細胞へ分化させた上で、その機能の変化を観察することにより、樹状細胞に発現する遺伝子の機能を解析できます。おもしろい機能分子が見つかった場合には、遺伝子改変ES細胞を受精卵に注入しマウス個体を得て、体内の樹状細胞における同遺伝子の機能を検討できます。また以下の図に示すように、遺伝子導入マウスES細胞より分化誘導した樹状細胞(ES-DC)
を利用して、抗原特異的にT細胞の免疫応答を制御する方法を開発しました。
たとえば、図5の左半分に示すように、ES細胞に抗原およびT細胞応答を増強する分子(具体的にはT細胞走化性ケモカイン)の遺伝子を共発現させた後に、ES-DCを分化誘導することにより、抗原特異的にT細胞の免疫応答を増強できるES-DC細胞ワクチンを開発しました。このシステムを利用して、マウスにおける抗腫瘍免疫誘導細胞ワクチンを開発しました(詳細は図6参照)。また、図5の右半分に示すように、ES-DCに自己抗原と免疫応答を抑制する分子の遺伝子を発現させることにより、抗原特異的に免疫応答を抑制できる免疫抑制性細胞ワクチンを開発しました。これを利用して、マウスの実験自己免疫性疾患を抑制することに成功しました(詳細は図7参照)。
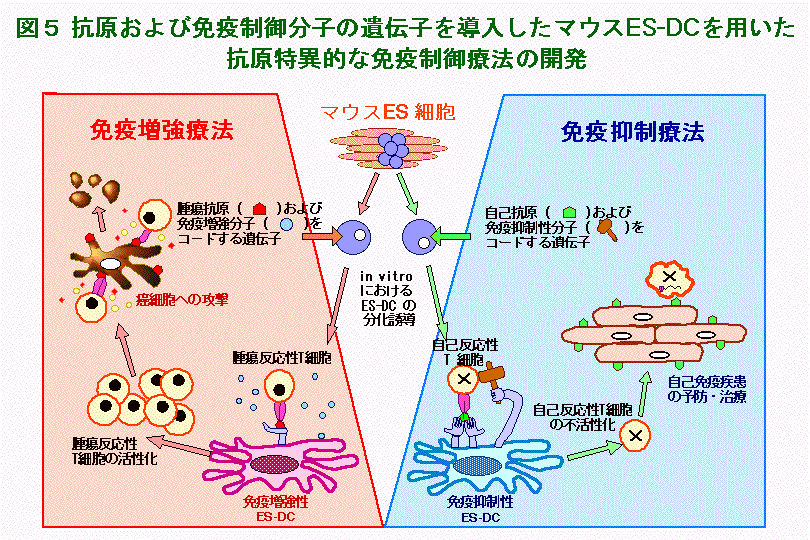
図6に抗腫瘍免疫を増強する免疫贈強性ES-DC細胞ワクチンについて示します。ES細胞にモデル腫瘍抗原(OVA:卵白アルブミン)とT細胞走化性をもつケモカイン(SLC, MigあるいはLptn)の遺伝子を導入し、高発現クローンを単離しました。これより、ES-DCを分化誘導してマウスの腹腔内に2回投与した後に、OVA遺伝子を発現させたマウスの悪性黒色腫(メラノーマ)細胞株(B16-OVAまたの名をMO4)を皮下に移植しました。その結果、特にOVAとSLC遺伝子を発現するES-DC(ES-DC-OVA/SLC)を投与したマウスでは、癌細胞の増殖が著明に抑制されるとともに、マウスの生存期間の延長が観察されました。実際にこのようなマウスでは、OVA特異的なキラーT細胞が強く活性化されており、腫瘍細胞に浸潤していることを確認しました。またマウスに抗体を投与してキラーT細胞を除去すると、このようなES-DCの抗腫瘍効果は消滅することが分かりました。(関連する英文論文および学位論文(和文))
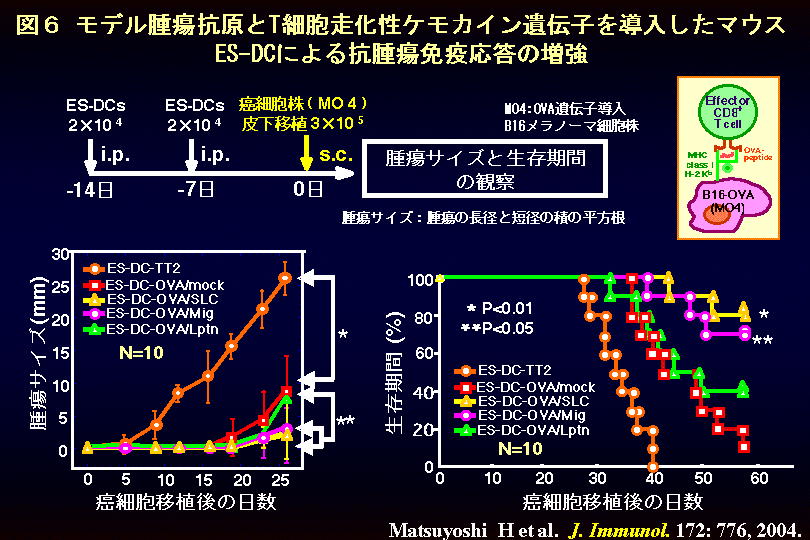
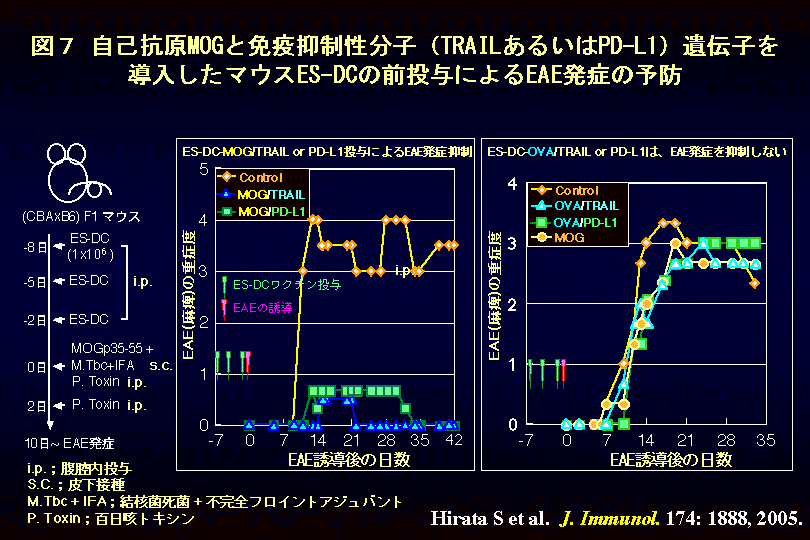
図7に実験自己免疫疾患の発症を抑制する免疫抑制性ES-DCワクチンについて示します。マウスの中枢神経系で刺激を伝達する神経繊維のまわりに、電気刺激を絶縁する組織(髄鞘)があります。この組織に含まれる物質である『ミエリン蛋白MOG』をマウスに免疫すると、多発性硬化症という神経性麻痺を発症する病気の動物モデルである、実験自己免疫性脳脊髄炎(EAE: Experimental autoimmune encephalomyelitis) を発症して、尾や四肢のマヒが発生します。図の左に示すように、ES細胞にMOGおよびT細胞応答を抑制する活性をもつTRAIL(トレイル)あるいはPD-L1の遺伝子を発現させ、ES-DCを分化誘導しました。これをマウスの腹腔内に3回投与した後に、MOGを免疫してEAEを誘導したところ、EAEの発症は著明に抑制されました。図の縦軸は臨床症状(麻痺の程度)を、横軸は時間(日)を示します。いっぽう、図の右に示すように、ES-DCにTRAILあるいはPD-L1と、EAEとは無関係の抗原である卵白アルブミン(OVA)の遺伝子を発現させたものをマウスに投与しても、EAEの発症には何ら影響を与えませんでした。つまり、上記のES-DCで誘導される免疫抑制は、MOG抗原に特異的なものであることが示されました。(関連する英文論文および学位論文(英文))
今後、このような方法がヒトにも応用できるかどうかを検討するために、ヒトのES細胞を用いた研究の準備を進めています。
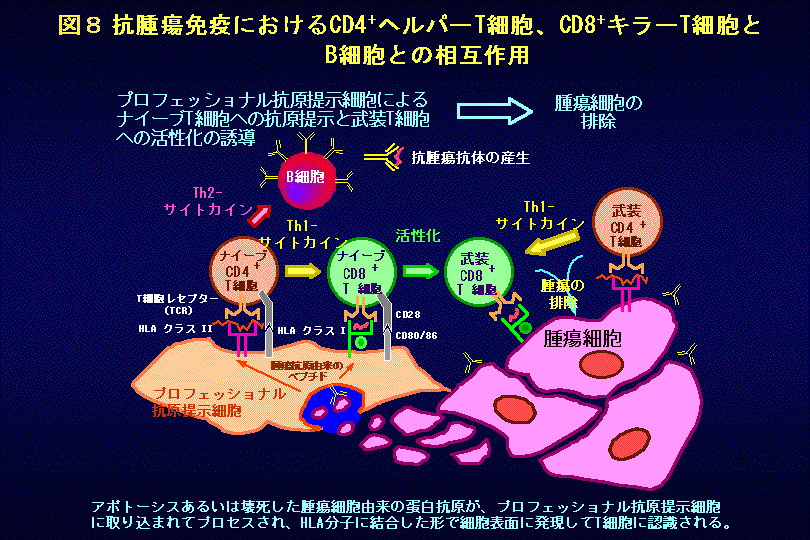
T細胞などの免疫担当細胞は癌細胞を見つけだし、これを攻撃して排除する機能も持っています。図8に示すように、樹状細胞などの抗原提示細胞は、アポトーシスやネクローシスにより死滅した癌細胞から遊離した細胞成分を細胞内に取り込み、エンドソーム内で分解して出来たペプチドをMHCクラスII分子のみならず、クラスI分子にも結合して細胞表面に発現します。後者の現象は、交差提示(Cross presentation)と呼ばれます。MHCクラスIIにより提示された腫瘍特異的に発現する抗原由来のペプチドは、CD4+Th細胞により認識され、活性化されたTh細胞は種々のサイトカインを産生して、腫瘍特異抗原に反応するキラーT細胞、抗原提示細胞あるいはB細胞を活性化します。いっぽう、CD8+キラーT細胞は、MHCクラスI分子により提示された腫瘍特異抗原ペプチドを認識して活性化され、腫瘍細胞に発現するMHCクラスI・腫瘍抗原ペプチド複合体を認識して、これを破壊します。樹状細胞にはCD80/CD86などの副刺激分子(Co-stimulatory molecules)が発現しており、これがT細胞のCD28と結合することにより、一度も抗原刺激を受けて活性化されたことがないナイーブT細胞を活性化して、より反応性が強いエフェクターT細胞への分化を誘導します。このような免疫応答の過程でB細胞も活性化され、腫瘍特異抗原に対する抗体が産生されます。腫瘍抗原が癌細胞の表面に発現している場合には、これに抗体が結合することにより、癌細胞の排除が起こる場合があります。
我々は癌の免疫療法に最適の腫瘍特異抗原を同定するために、東京大学医科学研究所の中村祐輔教授との共同研究を進めています。つまり、癌細胞と全身の正常組織における2万種類以上の遺伝子の発現をDNAマイクロアレイ法により比較検討し、癌細胞、免疫系から隔離された精巣および胎生期組織以外の成人正常組織には発現を認めないか、発現していてもごくわずかである遺伝子を探索しました。これらの腫瘍抗原に関して、まず癌の診断的な価値について検討します。たとえば、癌患者の血液の中に腫瘍抗原が検出できた場合、癌の早期発見、治療効果の判定、あるいは再発の早期検出などに利用します。さらに腫瘍細胞を殺す能力をもつT細胞が認識する、腫瘍抗原由来の抗原ペプチドとHLA分子の種類を決定します。このような腫瘍特異抗原ペプチドを用いて、より強い抗腫瘍免疫をT細胞に誘導できないかと期待しています。そして、もちろん研究成果を癌ワクチンとして、何とか臨床応用にまで、もって行きたいと考えています。
以下に当研究室で同定された腫瘍抗原の中から、cDNAマイクロアレイ解析により同定された肝臓癌および悪性黒色腫(メラノーマ)に特異的に発現する、新規癌胎児性抗原であるGlypican-3(GPC3)について紹介します。我々は東大医科研の中村祐輔博士らとの共同研究として、外科的に摘出された肝臓癌の癌組織と、これに近隣する正常肝臓組織を対象とした、23,040種類の遺伝子の発現をcDNAマイクロアレイにより解析した結果を頂く機会を得て、癌の免疫療法に理想的な癌特異抗原を選び出しました。まず図9に示すように、正常な肝臓組織に比べて肝臓癌組織で5倍以上遺伝子発現が増強し、さらに多くの成人正常組織では発現が弱いか、発現を認めない遺伝子を探索しました。その結果、見つけたGPC3は、肝臓癌組織と胎児の肝臓を含む組織でのみ強い発現を認めましたが、その他の組織には、ほとんど発現を認めませんでした。おそらく、この遺伝子は胎児の発生過程で重要な役割を演じており、肝臓癌になると再び遺伝子が発現する、いわゆる癌胎児性抗原(Oncofetal
antigen, Carcinoembryonic
antigen)であることが分かりました。(関連する英文論文)

またGPC3が肝細胞癌のみならず悪性黒色腫(メラノーマ)にも高発現することを発見した。さらに、図10に示すように、これら2種類の癌患者の約40%の血清中にGPC3が検出されましたが、肝硬変・慢性肝炎患者、色素性母班患者、健常人および他の多様な癌患者には検出されず、また癌摘出後に血清GPC3は陰性化したことより、GPC3の腫瘍マーカーとしての有用性を証明しました。GPC3は、既知の腫瘍マーカーとは相関せず、これらが陰性の患者にも検出され、さらに早期の癌患者にも検出される点で、従来の腫瘍マーカーよりも優れていました。(関連する英文論文)

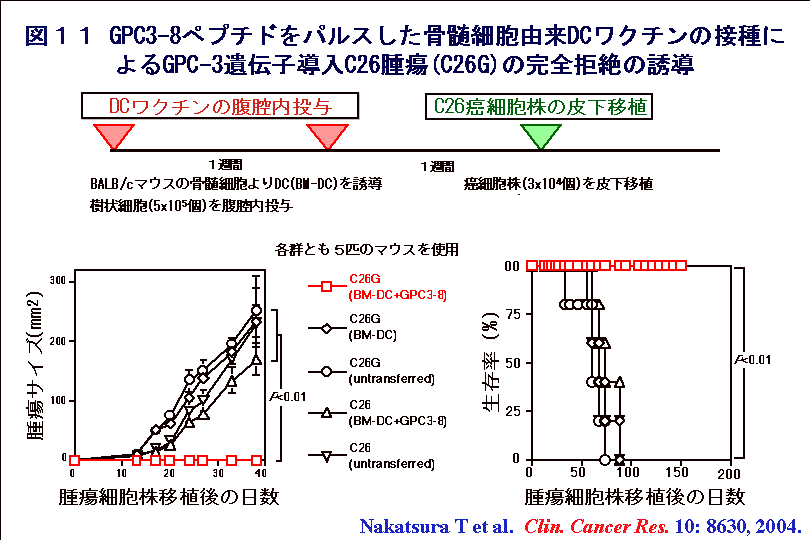
キラーT細胞に抗原ペプチドを提示するMHCクラスI分子であり、日本人において最も頻度が高く約60%のヒトが所有するHLA-A24と、BALB/cマウスが発現するMHCクラスI分子であるH-2Dbは構造が似ており、結合するペプチドの構造も良く似ています。そこで、図11に示すように、GPC3ペプチドを利用した癌ワクチンの安全性と有効性を、マウスを用いた動物実験により検討しました。ヒトとマウスのGPC3に共通なペプチドで、HLA-A24/H-2Dbに結合しやすいアミノ酸配列を有するペプチドを合成して、BALB/cマウスに免疫して脾臓細胞を再度in vitroでGPC3ペプチドにより刺激したところ、GPC3発現癌細胞を傷害するキラーT細胞を誘導できました。さらにマウスにGPC3ペプチドを負荷した骨髄細胞由来樹状細胞をin vivoに前投与することにより、自己免疫現象などの有害事象を伴うことなく、その後に移植した腫瘍を拒絶できることを証明しました。同様に、HLA-A24陽性の肝細胞癌患者の末梢血リンパ球をGPC3ペプチドで刺激することにより、HLA-A24およびGPC3を共に発現する癌細胞株を特異的に殺す、キラーT細胞を誘導できました。(関連する英文論文)
この他にも、我々はcDNAマイクロアレイ解析結果を利用して、多くの食道癌で特異的に高発現する新規腫瘍抗原であるProliferation
potential-related protein
(PP-RP)を同定しました。PP-RPは胎盤と精巣以外の正常臓器には、ほとんど発現しない核蛋白質であり、細胞分裂に伴い染色体に局在します。PP-RPの発現が非常に高い患者は予後不良であり、RNAiによるPP-RP遺伝子の発現抑制により食道癌細胞株の増殖は抑制され、PP-RPが癌化に関与している可能性が示唆されました。さらにペプチド特異的かつPP-RPおよびHLA-A24陽性癌細胞株を殺すヒトのキラーT細胞の誘導が食道癌患者で確認され、免疫療法への応用の可能性を示しました。(関連する英文論文および学位論文(和文))
癌患者の血清中には、癌細胞に特異的に発現する分子に対する抗体が存在します。このような抗体により認識される腫瘍特異抗原は、T細胞にも認識され癌細胞を攻撃する免疫応答を刺激します。癌細胞より抽出したmRNAよりcDNAを作り、これを蛋白として発現するファージライブラリーを作製して大腸菌に蛋白を作らせ、この中から患者の抗癌抗体に反応するクローンを選び出すことにより(SEREX法と呼びます)、以下のような免疫系の標的となる癌拒絶抗原を同定しました。
€
KM-HN-1;頭頸部扁平上皮癌患者血清と正常精巣由来cDNA発現ライブラリーを用いて、新規癌精巣
(Cancer-Testis: CT)
抗原KM-HN-1の遺伝子を同定しました。KM-HN-1は舌、甲状腺、胃および膵臓癌で発現し、分裂期には染色体に局在しました。多様な癌の患者血清中に、健常人より有意に高頻度で抗KM-HN-1抗体が検出されました。さらにHLA-A24により提示されたKM-HN-1ペプチドに特異的、かつ癌細胞株に細胞傷害活性を示すヒトCTLを誘導でき、抗腫瘍免疫療法への応用の可能性を示しました。(関連する英文論文および学位論文(和文))
HSP105; 膵癌患者血清と膵癌細胞株由来のcDNA発現ライブラリーを用いて、HSP105を同定した。HSP105蛋白質は、主に細胞質に発現しますが、正常組織では、精巣以外にはほとんど発現しないのに対し、膵癌、大腸癌、食道癌、甲状腺癌、乳癌(硬癌以外)など多様な癌のほとんどの症例で高発現することを発見しました。大腸腺腫における高発現は稀であり、HSP105は大腸の癌化の後期に発現すると推定されます。(関連する英文論文および学位論文(和文))
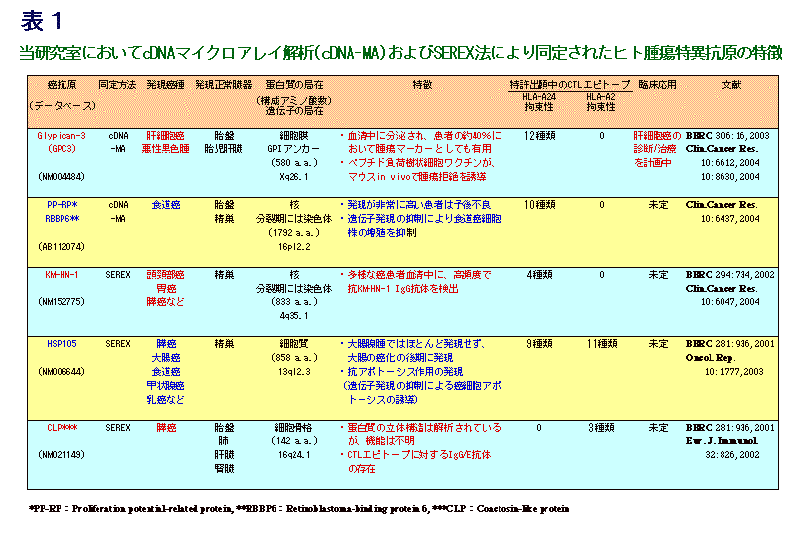
当研究室で同定された腫瘍特異抗原の主なものについて、その特徴を表1にまとめて以下に示します。これらのうち、Glypican-3に関しては、診断試薬の開発および免疫療法への応用を進めています。
新興・再興感染症を予防および治療するための、研究および開発が国家プロジェクトとして推進されています。我々は中華人民共和国の中国医学科学院、および北京協和医科大学の研究者らとの共同研究として、SARSウイルス抗原に対するT細胞応答を解析し、ワクチンの開発や病態解析に有用な情報を提供すべく研究を開始しました。